北京同步辐射光源用户在《自然》杂志发文揭示组蛋白变体甲基化识别新机制
清华大学医学院基础医学系、结构生物学中心李海涛教授课题组3月2日在《自然》杂志在线发表了题为“ZMYND11关联组蛋白变体H3.3赖氨酸36三甲基化(H3.3K36me3)修饰至转录延伸与肿瘤抑制”(ZMYND11 links H3.3K36me3 to transcription elongation and tumour suppression)” 的研究论文,首次报导了肿瘤抑制因子ZMYND11利用其串联“Bromo-ZnF-PWWP”结构域识别组蛋白变体H3.3K36me3修饰的分子机制,并探讨了该识别在转录延伸水平控制肿瘤发生的分子细胞机制,进一步揭开错综复杂的表观遗传调控的神秘面纱。
真核生物基因表达调控不仅依赖于特定的DNA 序列元件,而且还受到特定组蛋白翻译后修饰的精密调节。目前鉴定出的组蛋白修饰化学类型已超过25种,包括甲基化,酰基化,磷酸化等。这些组蛋白修饰及其组合被认为构成一组广义上的“组蛋白密码”,是表观遗传调控的重要机制之一。此外,各种组蛋白(H1,H2A, H2B,H3和H4)还普遍存在不同的序列变体。组蛋白变体和组蛋白修饰赋予组蛋白巨大的信息荷载能力,参与构成一层超越DNA序列的表观遗传信息,在染色质结构调节及基因表达调控等过程中起着关键作用。目前发现很多疾病与组蛋白修饰异常有着非常重要的关联,因此研究组蛋白修饰的产生,消除以及读取机制,对深入了解基因功能调控机制以及疾病的发生和治疗等都有着重要意义。
本研究首次揭示出生物体内存在组蛋白变体特异的甲基化识别蛋白。这种对组蛋白变体和甲基化修饰类型的双重识别,是组蛋白修饰识别机制上的新亮点,体现了真核生物表观遗传调控的复杂性和重要性。相关结构研究成果也为后续ZMYND11靶向的小分子抑制剂筛选,以及基于结构的药物设计提供了重要理论基础.
本论文是在清华大学李海涛教授(结构生物学),美国安德森癌症中心石晓冰助理教授(细胞生物学),以及美国贝勒医学院李蔚助理教授(生物信息学)的通力协作下完成的。整个论文涵盖了结构生物学、细胞生物学和功能基因组学等方面研究内容,充分体现了当前生命科学研究中多学科深度交叉的趋势。
在该项研究中,李海涛教授课题组利用北京同步辐射光源生物大分子晶体学光束线站线站(1W2B)收集了一套ZMYND11 Bromo-ZnF-PWWP晶体在锌原子吸收边附近(1.2825 Å)分辨率为1.95 Å的衍射数据。随后,利用锌-单波长反常散射法破解了非多肽结合条件下Bromo-ZnF-PWWP串联结构域相位,并完成结构解析。这一工作为后续的促结晶突变体设计,复合物晶体生长,以及结构测定奠定了重要基础。数据采集过程中得到北京同步辐射光源及其线站工作人员的大力协助。本研究工作得到科技部973,自然科学基金委面上等项目资助。
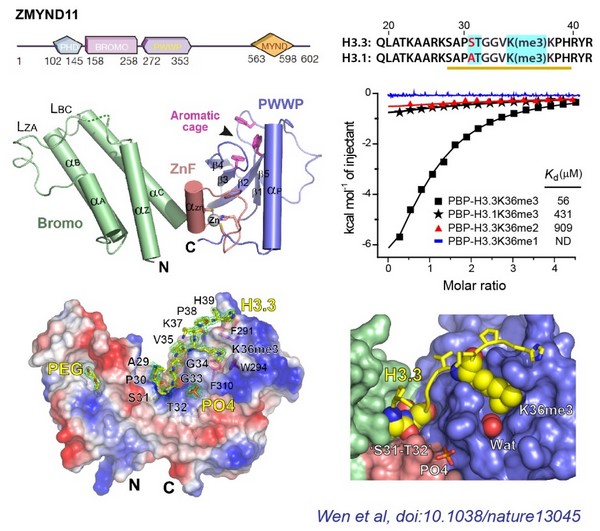
图 1:ZMYND11蛋白Bromo-ZnF-PWWP结构域晶体结构及其对H3.3变体K36me3的特异识别
